石川 稔
Teamケミカルプロテインノックダウンの新展開
研究分担者 石川 稔東北大学大学院 生命科学研究科 活性分子動態分野 教授 |
研究概要
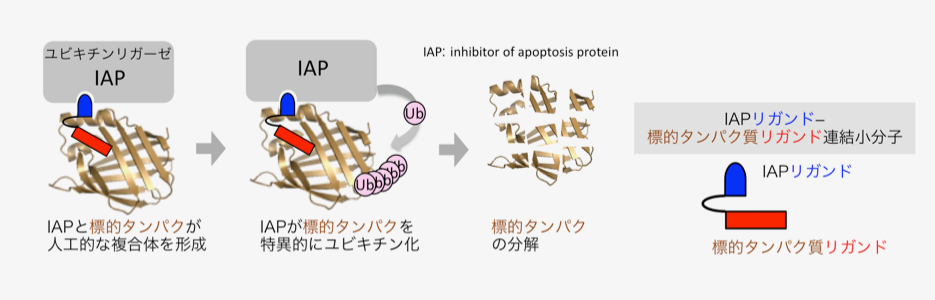
低分子創薬の分子基盤は、阻害薬・拮抗薬など、疾患関連タンパク質の機能制御が主流であり、この関係は「鍵と鍵穴」に例えられます。「鍵と鍵穴創薬」の成功例が多い一方で、薬らしいリガンドが発見されていない疾患関連タンパク質については、創薬成功例が少ないのが課題です。私達はこの課題を克服すべく、低分子によって標的タンパク質の寿命を短縮する手法を開発しました。即ち、レチノイン酸結合タンパク質(CRABP)の基質とユビキチンリガーゼの1種cIAP1リガンド(ベスタチンメチルエステル)を連結した合成低分子が、CRABPの分解を誘導することを2010年に発表しました。CRABPは、神経芽腫の遊走に関与しているものの、その低分子阻害剤が知られていない基質結合タンパク質です。私達は、低分子によるCRABP減少により、神経芽腫の遊走を抑制できることも示しました。なお、cIAP1とベスタチンメチルエステルが結合することは、国立衛研の内藤先生らの発見で、本研究は内藤先生との共同研究です。次に私達は、別のIAPsリガンド(IAPパンアンタゴニスト)を連結させた方が、標的タンパク質の分解効率が良いことを2012年に発表しました。ところで神経変性疾患は、疾患原因タンパク質の異常凝集により発症し、根治療法が存在しない難病です。私達は、凝集タンパク質に特異的に結合する神経変性疾患診断薬とcIAP1リガンドの連結低分子が、凝集性タンパク質を減少させる結果を2017年に報告し、神経変性疾患に対する創薬手法を提案に至りました。2015年以降、より低濃度でタンパク質の寿命を短縮する低分子が続々と報告され、動物モデルで有効性を示す例も発表されています。私達は、低分子によるタンパク質分解を発表したこと、標的タンパク質の種類と細胞内局在の適用範囲を調べたこと、根治療法が存在しない難病に対して治療戦略の提案に至ったことにより、世界的に注目されている創薬手法の構築に貢献しました。
研究概要を示す模式図
本領域での研究成果
- Nishiyama Y, Fujii S, Makishima M, Hashimoto Y, Ishikawa M.
Efficient lead finding, activity enhancement and preliminary selectivity control of nuclear receptor ligands bearing a phenanthridinone skeleton.
Int. J. Mol. Sci. 19, 2090 (2018)
PMID: 30021999 - Shioi R, Toyota Y, Noguchi-Yachide T, Ishikawa M, Yamaguchi T, Makishima M, Hashimoto Y, Ohgane K.
Unexpected emergence of luciferase-inhibitory activity during structural development study of phenyloxadiazole-based PPAR ligands.
Heterocycles 97, 854-864 (2018) - Yamashita H, Tomoshige S, Nomura S, Ohgane K, Hashimoto Y, Ishikawa M.
Application of Protein Knockdown Strategy Targeting β-Sheet Structure to Multiple Disease-associated Polyglutamine Proteins.
Bioorg. Med. Chem. 28, 115175 (2020)
PMID: 31767406 - Ichikawa Y, Hiramatsu M, Mita Y, Makishima M, Matsumoto Y, Masumoto Y, Muranaka A, Uchiyama M, Hashimoto Y, *Ishikawa M.
meta-Non-flat substituents: a novel molecular design to improve aqueous solubility in small molecule drug discovery.
Org. Biomol. Chem. 19, 446-456 (2021)
PMID: 33331380 - Nakane K, *Sato S, Niwa T, Tsushima M, Tomoshige S, Taguchi H, Ishikawa M, Nakamura H.
Proximity Histidine Labeling by Umpolung Strategy Using Singlet Oxygen.
J. Am. Chem. Soc. 143, 7726-7731 (2021)
PMID: 33904715 - Morimoto J, Miyamoto K, Ichikawa Y, Uchiyama M, Makishima M, Hashimoto Y, *Ishikawa M.
Improvement in aqueous solubility of achiral symmetric cyclofenil by modification to a chiral asymmetric analog.
Sci. Rep. 11, 12697 (2021)
PMID: 34135380 - Obara S, Nakane K, Fujimura C, Tomoshige S, Ishikawa M, *Sato S.
Functionalization of Human Serum Albumin by Tyrosine Click.
Int. J. Mol. Sci. 22, 8676-8676 (2021)
PMID: 34445381 - Hirai K, Yamashita H, *Tomoshige S, Mishima Y, Niwa T, Ohgane K, Ishii M, Kanamitsu K, Ikemi Y, Nakagawa S, Taguchi H, Sato S, Hashimoto Y, *Ishikawa M.
Conversion of a PROTAC mutant huntingtin degrader into small-molecule hydrophobic tags focusing on drug-like properties.
ACS Med. Chem. Lett. 13, 396-402 (2022)
PMID: 35300080 - Nakane K, Niwa T, Tsushima M, Tomoshige S, Taguchi H, Nakamura H, Ishikawa M, Sato S.
BODIPY Catalyzes Proximity‐Dependent Histidine Labelling.
ChemCatChem 14, e202200077 (2022) - Nakane K, Nagasawa H, Fujimura C, Koyanagi E, Tomoshige S, Ishikawa M, Sato S.
witching of Photocatalytic Tyrosine/Histidine Labeling and Application to Photocatalytic Proximity Labeling.
Int. J. Mol. Sci. 23, 11622 (2022)
PMID: 36232972
代表的な論文
- Itoh Y, Ishikawa M, Naito M, *Hashimoto Y.
Protein knockdown using methyl bestatin-ligand hybrid molecules: design and synthesis of inducers of ubiquitination-mediated degradation of cellular retinoic acid-binding proteins.
J. Am. Chem. Soc. 132, 5820-5826 (2010)
PMID: 20369832 - *Ishikawa M, Hashimoto Y.
Improvement in aqueous solubility in small molecule drug discovery programs by disruption of molecular planarity and symmetry.
J. Med. Chem. 54, 1539-1554 (2011)
PMID: 21344906 - Itoh Y, Ishikawa M, Kitaguchi R, Okuhira K, Naito M, *Hashimoto Y.
Double protein knockdown of cIAP1 and CRABP-II using a hybrid molecule consisting of ATRA and IAPs antagonist.
Bioorg.Med. Chem. Lett. 22, 4453-4457 (2012)
PMID: 22658364 - Aoyama A, Endo-Umeda K, Kishida K, Ohgane K, Noguchi-Yachide T, Aoyama H, Ishikawa M, Miyachi H, Makishima M, *Hashimoto Y.
Design, synthesis, and biological evaluation of novel transrepression-selective liver X receptor (LXR) ligands with 5,11-dihydro-5-methyl-11-methylene-6Hdibenz[b,e]azepin-6-one skeleton.
J. Med. Chem. 55, 7360-7377 (2012)
PMID: 22873709 - Tomoshige S, Nomura S, Ohgane K, Hashimoto Y, *Ishikawa M.
Discovery of small molecules that induce the degradation of huntingtin.
Angew. Chem. Int. Ed. 56, 11530-11533 (2017)
PMID: 28703441





