福嶋 俊明
USP8の自己阻害機構の理解に基づく阻害剤開発とクッシング病治療への応用
 |
研究代表者 福嶋 俊明東京工業大学 駒田研究室 助教 |
|---|
研究概要
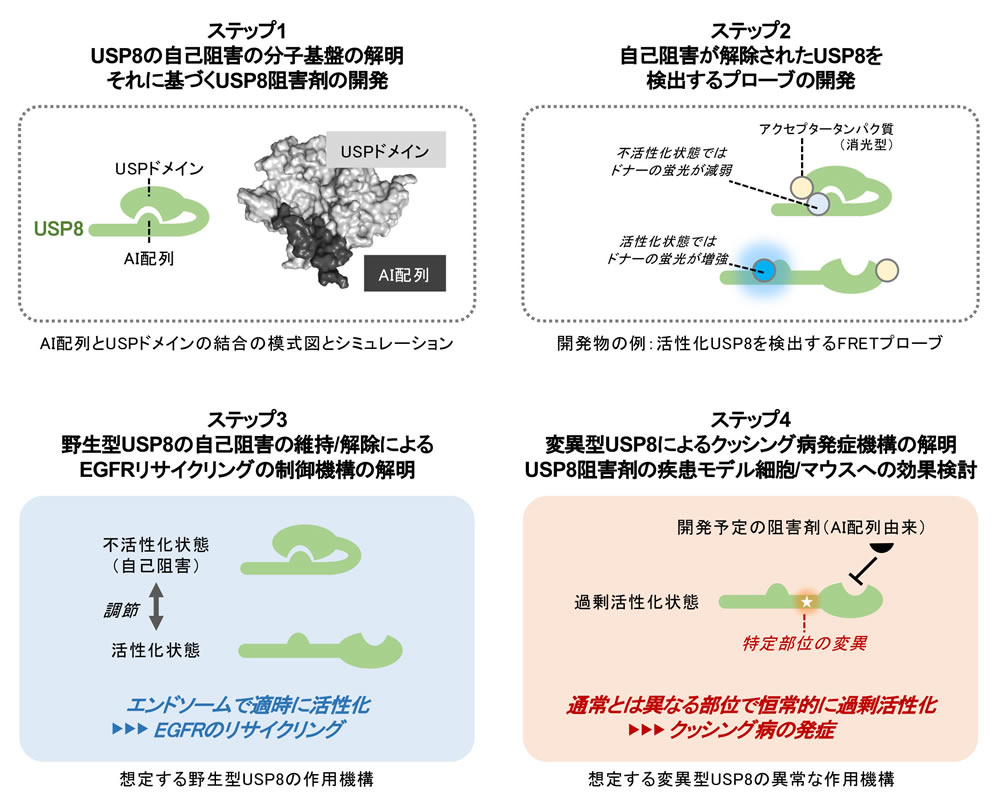
脱ユビキチン化酵素は様々な細胞機能に関与し、種々の疾患とも関係することから注目を集めています。私たちは、長年、USPファミリーの脱ユビキチン化酵素の機能解析を進めてきました。その過程で、USP8が、エンドサイトーシスにより細胞内にとり込まれた増殖因子受容体をエンドソームで脱ユビキチン化し、これらの細胞膜へのリサイクリングを促すことを明らかにしてきました。これは、増殖シグナルの強度を調節し、細胞増殖をコントロールするための重要なしくみと考えられ、このしくみを制御する分子機構の解明は重要です。一方、私たちは、USP8がクッシング病の原因遺伝子であることを発見しました。クッシング病は下垂体から副腎皮質刺激ホルモン(ACTH)が過剰に分泌されて起こる難病で、特異的な治療薬は存在しません。世界初のクッシング病治療薬を開発するために、USP8の変異を出発点とする発症機構の解明は喫緊の課題であると言えます。
前回の公募研究の成果から、USP8には特殊な自己阻害機構が備わっていて、分子中央部に存在する短いアミノ酸配列(Auto-Inhibitory sequence: AI配列)が酵素ドメイン(USPドメイン)に相互作用して活性を抑制することがわかりました。他の成果も併せ、私たちは、『細胞内では自己阻害が適時適所で解除されることによりUSP8が正しく機能して受容体リサイクリングが制御されている。一方、クッシング病ではこのしくみが破綻してUSP8が過剰に活性化し、疾患発症をもたらしている。自己阻害機構に基づいてUSP8阻害剤を開発できる可能性があり、成功すれば世界初のクッシング病治療薬のシーズになる』と着想しました。
本研究では、まず、USP8の自己阻害の分子基盤を詳細に解明し、それに基づいてUSP8阻害剤などの新しい解析ツールを開発します。さらに、これを最大限に活用して、野生型USP8のエンドサイトーシスにおける作用機構と変異型USP8のクッシング病発症における作用機構を明らかにすることを目的としています。本研究によって、USPファミリータンパク質の阻害剤開発の新しいストラテジーを提案するとともに、新しい解析ツールを活用してこれまで遺伝学的解析一辺倒だった脱ユビキチン化酵素研究に新展開をもたらしたいです。さらに、開発したUSP8阻害剤がクッシング病治療に応用できる可能性を示したいと考えています。
研究概要を示す模式図
- *Beziat V, Rapaport F, Hu J, Titeux M, Bonnet des Claustres M, Bourgey M, Griffin H, Bandet E, Ma CS, Sherkat R, Rokni-Zadeh H, Louis DM, Changi-Ashtiani M, Delmonte OM, Fukushima T, Habib T, Guennoun A, Khan T, Bender N, Rahman M, About F, Yang R, Rao G, Rouzaud C, Li J, Shearer D, Balogh K, Al Ali F, Ata M, Dabiri S, Momenilandi M, Nammour J, Alyanakian MA, Leruez-Ville M, Guenat D, Materna M, Marcot L, Vladikine N, Soret C, Vahidnezhad H, Youssefian L, Saeidian AH, Uitto J, Catherinot E, Navabi SS, Zarhrate M, Woodley DT, Jeljeli M, Abraham T, Belkaya S, Lorenzo L, Rosain J, Bayat M, Lanternier F, Lortholary O, Zakavi F, Gros P, Orth G, Abel L, Pretet JL, Fraitag S, Jouanguy E, Davis MM, Tangye SG, Notarangelo LD, Marr N, Waterboer T, Langlais D, Doorbar J, Hovnanian A, Christensen N, Bossuyt X, Shahrooei M, *Casanova JL.
Humans with inherited T cell CD28 deficiency are susceptible to skin papillomaviruses but are otherwise healthy.
Cell 184, 3812-3828 (2021)
PMID: 34214472 - Kakihara K, Asamizu K, Moritsugu K, Kubo M, Kitaguchi T, Endo A, Kidera A, Ikeguchi M, Kato A, *Komada M, *Fukushima T.
Molecular basis of ubiquitin-specific protease 8 autoinhibition by the WW-like domain.
Commun. Biol. 4, 1272 (2021)
PMID: 34750505 - Fukushima T, Yoshihara H, Furuta H, Hakuno F, Luan J, Duan C, Saeki Y, Tanaka K, Iemura SI, Natsume T, Chida K, Nakatsu Y, Kamata H, Asano T, *Takahashi SI.
Nedd4-induced monoubiquitination of IRS-2 enhances IGF signaling and mitogenic activity.
Nat. Commun. 6, 6780 (2015)
PMID: 25879670 - Furuta H, Yoshihara H, Fukushima T, Yoneyama Y, Ito A, Worrall C, Girnita A, Girnita L, Yoshida M, Asano T, Komada M, Kataoka N, Chida K, Hakuno F, *Takahashi SI.
IRS-2 deubiquitination by USP9X maintains anchorage-independent cell growth via Erk1/2 activation in prostate carcinoma cell line.
Oncotarget. 9, 33871-33883 (2018)
PMID: 30338032 - Xie X, Matsumoto S, Endo A, *Fukushima T, Kawahara H, Saeki Y, *Komada M.
Deubiquitylases USP5 and USP13 are recruited to and regulate heat-induced stress granules through their deubiquitylating activities.
J. Cell Sci. 131, jcs210856 (2018)
PMID: 29567855 - Kawaguchi K, Endo A, *Fukushima T, Madoka Y, Tanaka T, *Komada M.
Ubiquitin-specific protease 8 deubiquitinates Sec31A and decreases large COPII carriers and collagen IV secretion.
Biochem. Biophys. Res. Commun. 499, 635-641 (2018)
PMID: 29604273 - Naito S, *Fukushima T, Endo A, Denda K, *Komada M.
Nik-related kinase is targeted for proteasomal degradation by the chaperone-dependent ubiquitin ligase CHIP.
FEBS Lett. 594, 1778-1786 (2020)
PMID: 32162334





