合山 進
シャペロン介在型E3リガーゼSTUB1を軸としたプロテオスタシス調節薬の開発
 |
研究代表者 合山 進東京大学 新領域創成科学研究科 先進分子腫瘍学分野 教授 |
|---|
研究概要
細胞内のプロテオスタシスは、タンパク質の合成、フォールディング、分解のバランスによって保たれています。HSP70やHSP90などの熱ショックタンパク質は、分子シャペロンとして様々なタンパク質のフォールディングを介助し、プロテオスタシスの維持に貢献しています。また、E3ユビキチンリガーゼSTUB1は、フォールディングに失敗したタンパク質をユビキチン化し、ユビキチン-プロテアソーム経路を介して分解を誘導する役割を担っています。私達は以前に、造血系転写因子RUNX1をユビキチン化して分解するE3 リガーゼとしてSTUB1 を同定し、以後STUB1 を軸とした創薬研究を進めてきました。これまでに、バーチャルスクリーニング及びサーマルシフトアッセイを行い、低濃度でSTUB1に結合する複数の化合物を同定しました。また、STUB1と熱ショックタンパク質との複雑な協調作用について解析を進めています。
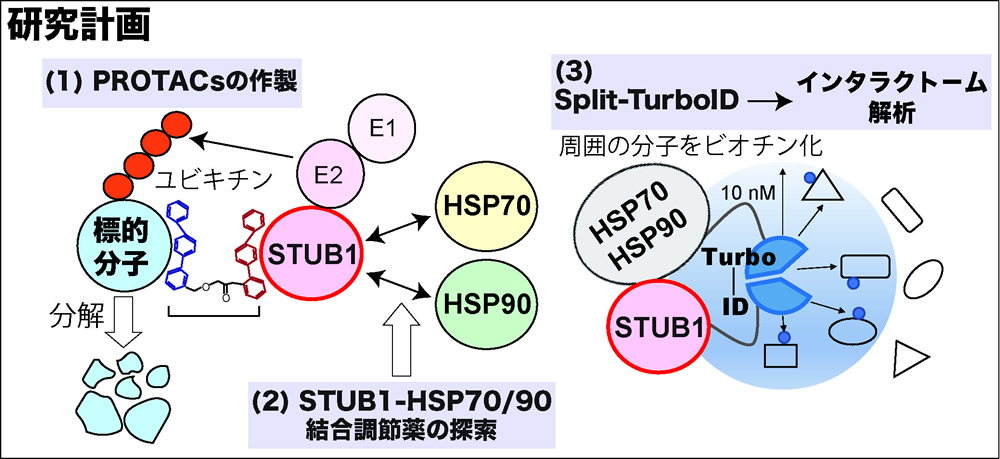
本研究では、これまでに同定したSTUB1 結合化合物を活用して、STUB1 による標的分子の分解を誘導するProteolysis Targeting Chimera (PROTACs)の作製を目指します。PROTACsの作製にはこれまでE3リガーゼVHLやCRBNが使用されてきましたが、元々様々なタンパク質の品質管理を請け負っているSTUB1を活用したPROTACsを開発できれば、より生理的かつ効果的に標的タンパクの分解を誘導できる可能性があります。また、STUB1とHSP70、HSP90の結合を検出するコムギ無細胞AlphaScreenを確立し、HSP70、HSP90との結合を阻害、もしくは増強する化合物を探索します。このような化合物は、細胞内でSTUB1の機能を調節する効果を持つことが期待されます。さらに、周囲の分子をビオチン化するリガーゼTurboIDを分割し、2分子が相互作用した時のみ働くSplit-TurboIDの手法を用いて、STUB1-HSP70 複合体およびSTUB1-HSP90複合体のインタラクト−ム解析を行います。これにより、それぞれの複合体が持つ機能の類似点および相違点を明らかにすることができます。以上の結果を統合して、シャペロン介在型E3リガーゼSTUB1を軸とした新しいプロテオスタシス調節薬の開発を目指したいと思います。
研究概要を示す模式図
本領域での研究成果
- Yamamoto K, Goyama S, Asada S, Fujino T, Yonezawa T, Sato N, Takeda R, Tsuchiya A, Fukuyama T, Tanaka Y, Yokoyama A, Toya H, Kon A, Nannya Y, Onoguchi-Mizutani R, Nakagawa S, Hirose T, Ogawa S, Akimitsu N, *Kitamura T.
A histone modifier ASXL1 interacts with NONO and is involved in paraspeckle formation in hematopoietic cells.
Cell Rep. 36, 109576 (2021)
PMID: 34433054
プレスリリース
代表的な論文
- Goyama S, Yamamoto G, Shimabe M, Sato T, Ichikawa M, Ogawa S, Chiba S, *Kurokawa M.
Evi-1 is a critical regulator for hematopoietic stem cells and transformed leukemic cells.
Cell Stem Cell 3, 207-220 (2008)
PMID: 18682242 - Goyama S, Schibler J, Cunningham L, Zhang Y, Rao Y, Nishimoto N, Nakagawa M, Olsson A, Wunderlich M, Link KA, Mizukawa B, Grimes HL, Kurokawa M, Liu PP, Huang G, *Mulloy JC.
Transcription factor RUNX1 promotes survival of acute myeloid leukemia cells.
J. Clin. Investig. 123, 3876-88 (2013)
PMID: 23979164 - Goyama S, Wunderlich M, *Mulloy JC.
Xenograft models for normal and malignant stem cells.
Blood 125, 2630-2640 (2015)
PMID: 25762176 - Yonezawa T, Takahashi H, Shikata S, Liu X, Tamura M, Asada S, Fukushima T, Fukuyama T, Tanaka Y, Sawasaki T, Kitamura T, *Goyama S.
The ubiquitin ligase STUB1 regulates stability and activity of RUNX1 and RUNX1-RUNX1T1.
J. Biol. Chem. 292,12528-12541 (2017)
PMID: 28536267 - Hayashi Y, *Goyama S, Liu X, Tamura M, Asada S, Tanaka Y, Fukuyama T, Wunderlich M, O’Brien E, Mizukawa B, Yamazaki S, Matsumoto A, Yamasaki S, Shibata T, Matsuda K, Sashida G, Takizawa H, *Kitamura T.
Antitumor immunity augments the therapeutic effects of p53 activation on acute myeloid leukemia.
Nat. Commun. 10, 4869 (2019)
PMID: 31653912





