松沢 厚
ユビキチンケモテクノロジーを活用した細胞生死バランス制御による疾患治療戦略の開発
 |
研究代表者 松沢 厚東北大学大学院 薬学研究科 衛生化学分野 教授 |
|---|
研究概要
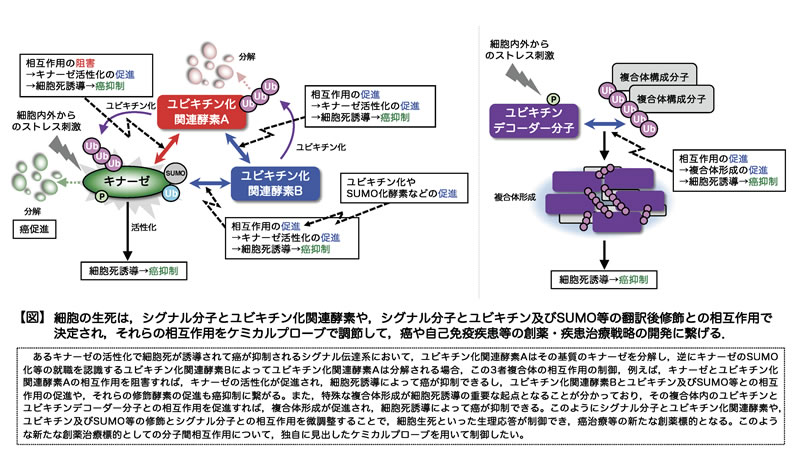
細胞の生死などの生理応答は、細胞内外から入力される様々な増殖・分化・細胞死などのシグナルのバランスによって決定されています。最近我々は、細胞生死に関わるシグナル分子に対して複数のユビキチン化関連酵素がクラスタリングして複合体を形成し、相互に活性制御を行うこと、またストレス刺激依存的にユビキチンとユビキチンデコーダ分子で構成される特殊な複合体が形成されることを見出しました。これらの現象は、細胞の生死を決定するシグナルバランスの微調整に重要であり、ストレスの種類や強度に応じた適切な細胞応答が誘導されるための普遍的な仕組みであることが分かってきました。そのバランスが崩れると異常なシグナルが誘導されて過剰な細胞死や増殖が起こり、癌や自己免疫疾患に繋がります。また我々は、複合体内の構成因子の相互作用には、ユビキチン化やSUMO化、リン酸化等の修飾が必須であることも明らかにしており、従って、このような修飾や相互作用を制御できれば、過剰な細胞死や増殖を抑制し、細胞生死シグナルのバランス破綻による癌や自己免疫疾患等の疾患治療が可能となります。
例えば、細胞生死を調節する、あるキナーゼには、その活性制御を行う、異なるユビキチン化関連酵素が存在して複合体を形成し、一方のユビキチン化関連酵素は直接、キナーゼのユビキチン化分解に関わり、もう一方のユビキチン化関連酵素は一方のユビキチン化関連酵素のユビキチン化分解に寄与するという、シグナルの複雑な微調整の仕組みが存在します。またストレス刺激に応じて、ユビキチンとユビキチンデコーダ分子を構成因子とする複合体の形成が、特殊な細胞死誘導の制御に重要です(【図】参照)。これらの分子間の相互作用には、ユビキチン化等の修飾が必要であることも分かってきました。このような複合体形成メカニズムや細胞生死シグナルのバランス制御の仕組みを解明し、シグナル分子間相互作用やデコーダ分子による修飾認識が、細胞生死のシグナルバランスの決定に重要なポイント(作用点)であり、それらのポイントがケモテクノロジーによって人為的に調節制御可能であると考えています。
本研究では、我々が独自に見出した低分子プローブを基に、ケモテクノロジーを活用して、ユビキチン化関連酵素間の相互作用や、ユビキチン化関連修飾とユビキチン化関連酵素を含むシグナル分子との相互作用を正・負に適切に調節することで、細胞生死といった生理応答のシグナルバランス制御を介して過剰な細胞死・増殖等の現象を抑制し、癌や免疫疾患に対する、従来の方法とは異なる新たな疾患治療戦略の提言を目指したいと考えています。
研究概要を示す模式図
本領域での研究成果
- Toyama T, Hoshi T, Noguchi T, Saito Y, Matsuzawa A, Naganuma A, *Hwang G W.
Methylmercury induces neuronal cell death by inducing TNF-α expression through the ASK1/p38 signaling pathway in microglia.
Sci. Rep. 11, 9832 (2021)
PMID: 33972601 - Hirata Y, Takahashi M, Yamada Y, Matsui R, Inoue A, Ashida R, Noguchi T, *Matsuzawa A.
trans-Fatty acids promote p53-dependent apoptosis triggered by cisplatin-induced DNA interstrand crosslinks via the Nox-RIP1-ASK1-MAPK pathway.
Sci. Rep. 11, 10350 (2021)
PMID: 33990641
プレスリリース - Shimada T, Kudoh Y, Noguchi T, Kagi T, Suzuki M, Tsuchida M, Komatsu H, Takahashi M, Hirata Y, *Matsuzawa A.
The E3 Ubiquitin-Protein Ligase RNF4 Promotes TNF-α-Induced Cell Death Triggered by RIPK1.
Int. J. Mol. Sci. 22, 5796 (2021)
PMID: 34071450 - Kagi T, Naganuma R, Inoue A, Noguchi T, Hamano S, Sekiguchi Y, Hwang G W, Hirata Y, *Matsuzawa A.
The polypeptide antibiotic polymyxin B acts as a pro-inflammatory irritant by preferentially targeting macrophages.
J. Antibiot. 75, 29-39 (2022)
PMID: 34824374 - Shimada T, Yabuki Y, Noguchi T, Tsuchida M, Komatsu R, Hamano S, Yamada M, Ezaki Y, Hirata Y, *Matsuzawa A.
The distinct roles of LKB1 and AMPK in p53-dependent apoptosis induced by cisplatin.
Int. J. Mol. Sci. 23, 10064 (2022)
PMID: 36077459 - Lee J Y, Kim J M, Noguchi T, Matsuzawa A, Naganuma A, *Hwang G W.
Deubiquitinase USP54 attenuates methylmercury toxicity in human embryonic kidney 293 cells.
Fudam. Toxicol. Sci. 9, 159-162 (2022) - Luo Y R, *Kudo T A, Tominami K, Izumi S, Tanaka T, Hayashi Y, Noguchi T, Matsuzawa A, Nakai J, Hong G, Wang H.
SP600125 enhances temperature-controlled repeated thermal stimulation-ynduced neurite outgrowth in PC12-P1F1 cells.
Int. J. Mol. Sci. 23, 15602 (2022)
PMID: 36555248 - Sekiguchi Y, Takano S, Noguchi T, Kagi T, Komatsu R, Tan M, Hirata Y, *Matsuzawa A.
The NLRP3 inflammasome works as a sensor for detecting hypoactivity of the mitochondrial Src family kinases.
J. Immunol. (2023)
PMID: 36744909
プレスリリース
代表的な論文
- Matsuzawa A, Tseng PH, Vallabhapurapu S, Luo JL, Zhang W, Wang H, Vignali DA, Gallagher E, *Karin M.
Essential cytoplasmic translocation of a cytokine receptor-assembled signaling complex.
Science (Research Article) 321, 663-668 (2008)
PMID: 18635759 - Hirata Y, Katagiri K, Nagaoka K, Morishita T, Kudoh Y, Hatta T, Naguro I, Kano K, Udagawa T, Natsume T, Aoki J, Inada T, Noguchi T, Ichijo H, *Matsuzawa A.
TRIM48 promotes ASK1 activation and cell death through ubiquitination-dependent degradation of the ASK1 negative regulator PRMT1.
Cell Rep. 21, 2447-2457 (2017)
PMID: 29186683 - Noguchi T, Suzuki M, Mutoh N, Hirata Y, Tsuchida M, Miyagawa S, Hwang G W, Aoki J, *Matsuzawa A.
Nuclear-accumulated SQSTM1/p62-based ALIS act as microdomains sensing cellular stresses and triggering oxidative stress-induced parthanatos.
Cell Death Dis. 9, 1193 (2018)
PMID: 30546061 - Hirata Y, Inoue A, Suzuki S, Takahashi M, Matsui R, Kono N, Noguchi T, *Matsuzawa A.
trans-Fatty acids facilitate DNA damage-induced apoptosis through the mitochondrial JNK-Sab-ROS positive feedback loop.
Sci. Rep. 10, 2743 (2020)
PMID: 32066809 - Noguchi T, Sekiguchi Y, Kudoh Y, Naganuma R, Kagi T, Nishidate A, Maeda K, Ishi C, Toyama T, Hirata Y, Hwang GW, *Matsuzawa A.
Gefitinib initiates sterile inflammation by promoting IL-1β and HMGB1 release via two distinct mechanisms.
Cell Death Dis. 12, 49 (2021)
PMID: 33414419





