高橋 宏隆
脱ユビキチン化酵素を標的としたタンパク質量制御化合物の開発
 |
研究代表者 高橋 宏隆愛媛大学 プロテオサイエンスセンター 無細胞生命科学部門 准教授 |
|---|
研究概要
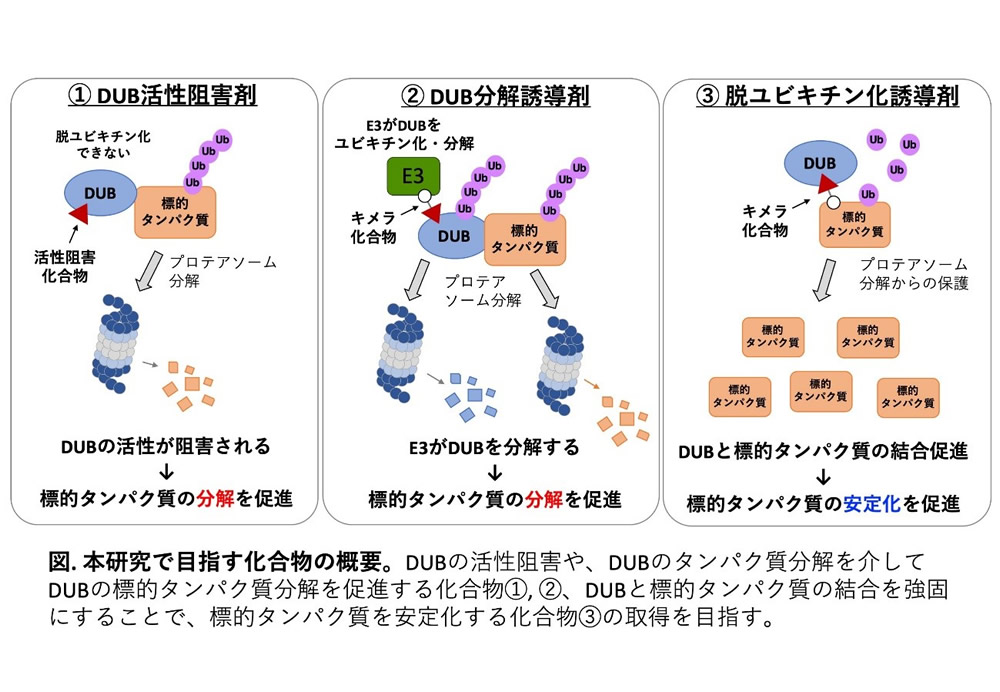
現在、キメラ化合物を用いて標的タンパク質をE3リガーゼ(E3)によって分解させるプロテインノックダウン技術として、PROTACやSNIPERの開発が精力的に行われています。しかし、これらの技術は標的タンパク質に特異的に結合する化合物の開発が難しいという問題点があり、対象となるタンパク質はまだ限定されています。そこで我々の研究で着目したのが脱ユビキチン化酵素(DUB)です。DUBはE3によってユビキチン化された標的タンパク質からユビキチンを除去する酵素で、多くのDUBが標的タンパク質をプロテアソーム分解から保護し、安定化させる役割を担っています。このDUBの活性を低分子化合物で制御することができれば、DUBによって保護されている標的タンパク質の分解誘導や、逆に更なる安定化を促進することが理論的には可能です。しかし、特定のDUBのみの活性を制御する化合物が実用化された例は非常に少ないのが現状です。その主たる要因は、DUBの酵素活性部位は構造的に保存性が高く、特異的なDUB阻害剤の開発が難しいことにあります。
我々は愛媛大学で開発したコムギ無細胞系を基盤に、in vitroでのハイスループットな薬剤探索技術を開発し、ヒトのDUBの半数を占めるUSPファミリーのみを特異的に阻害する化合物Subquinocinの取得に成功しています。そこで、Subquinocinを母核に化合物展開を行い、USPファミリーに属するDUBのうち、特定のUSPのみを選択的に機能制御できる化合物の取得を目指します。この化合物を基盤に、DUBによるタンパク質ノックダウン技術(図の①、②)や逆に安定化技術(図の③)の開発が可能になると考えました。本研究では、標的タンパク質が既に解明されており、がんや神経変性疾患への関与が報告されているUSP15を中心に研究を進めます。既に報告されているUSP15の結晶構造をもとに、in silico解析によるドッキングモデルと構造解析を駆使し、SubquinocinのUSPへの特異性・結合力・阻害活性を自在に改変した誘導体化合物をデザインし、それらを用いてUSP15やその他のUSPが細胞内で標的とするタンパク質の量の制御を試みます。これらをモデルとして、DUBを標的とした化合物によるタンパク質量制御技術の開発を目指します。
研究概要を示す模式図
本領域での研究成果
- Takaoka Y, Suzuki K, Nozawa A, Takahashi H, Sawasaki T, Ueda M.
Protein-protein interactions between jasmonate-related master regulator MYC and transcriptional mediator MED25 depend on a short binding domain.
J Biol Chem. 298, 101504 (2022)
PMID: 34929168 - Shioya R, Yomada K, Kido K, Takahashi H, Nozawa A, Miyakawa T, Kosako H, Sawasaki T.
A simple method for labeling proteins and antibodies with biotin using the proximity biotinylation enzyme TurboID.
Biochem Biophys Res Commun. 592, 54-59 (2022)
PMID: 35030423 - Oikawa D, Gi M, Kosako H, Shimizu K, Takahashi H, Shiota M, Hosomi S, Komakura K, Wanibuchi H, Tsuruta D, Sawasaki T, Tokunaga F.
OTUD1 deubiquitinase regulates NF-κB- and KEAP1-mediated inflammatory responses and reactive oxygen species-associated cell death pathways.
Cell Death Dis. 13, 694 (2022)
PMID: 35941131
代表的な論文
- Takahashi H, Uematsu A, Yamanaka S, Imamura M, Nakajima T, Doi K, Yasuoka S, Takahashi C, Takeda H, *Sawasaki T.
Establishment of a Wheat Cell-Free Synthesized Protein Array Containing 250 Human and Mouse E3 Ubiquitin Ligases to Identify Novel Interaction between E3 Ligases and Substrate Proteins.
PLoS ONE 11, e0156718 (2016)
PMID: 27249653 - Uematsu A, Kido K, Takahashi H, Takahashi C, Yanagihara Y, Saeki N, Yoshida S, Maekawa M, Honda M, Kai T, Shimizu K, Higashiyama S, Imai Y, Tokunaga F, *Sawasaki T.
The E3 ubiquitin ligase MIB2 enhances inflammation by degrading the deubiquitinating enzyme CYLD.
J. Biol. Chem. 294, 14135–14148 (2019)
PMID: 31366726 - Yamanaka S, Sato Y, Oikawa D, Goto E, Fukai S, Tokunaga F, *Takahashi H, *Sawasaki T.
Subquinocin, a small molecule inhibitor of CYLD and USP-family deubiquitinating enzymes, promotes NF-κB signaling.
Biochem. Biophys. Res. Commun. 524, 1-7 (2020)
PMID: 31898971 - *Takahashi H, Yamanaka S, Kuwada S, Higaki K, Kido K, Sato Y, Fukai S, Tokunaga F, *Sawasaki T.
A Human DUB Protein Array for Clarification of Linkage Specificity of Polyubiquitin Chain and Application to Evaluation of Its Inhibitors.
Biomedicines 8, 152 (2020)
PMID: 32512835 - Yamanaka S, Murai H, Saito D, Abe G, Tokunaga E, Iwasaki T, Takahashi H, Takeda H, Suzuki T, Shibata N, Tamura K, Sawasaki T.
Thalidomide and its metabolite 5-hydroxythalidomide induce teratogenicity via the cereblon neo-substrate PLZF.
EMBO journal. 40, e105375 (2021)
PMID: 33470442





