松沢 厚
ユビキチンケモテクノロジーを活用した細胞生死バランス制御による疾患治療戦略の開発
 |
研究代表者 松沢 厚東北大学 大学院薬学研究科 衛生化学分野 教授 |
|---|
研究概要
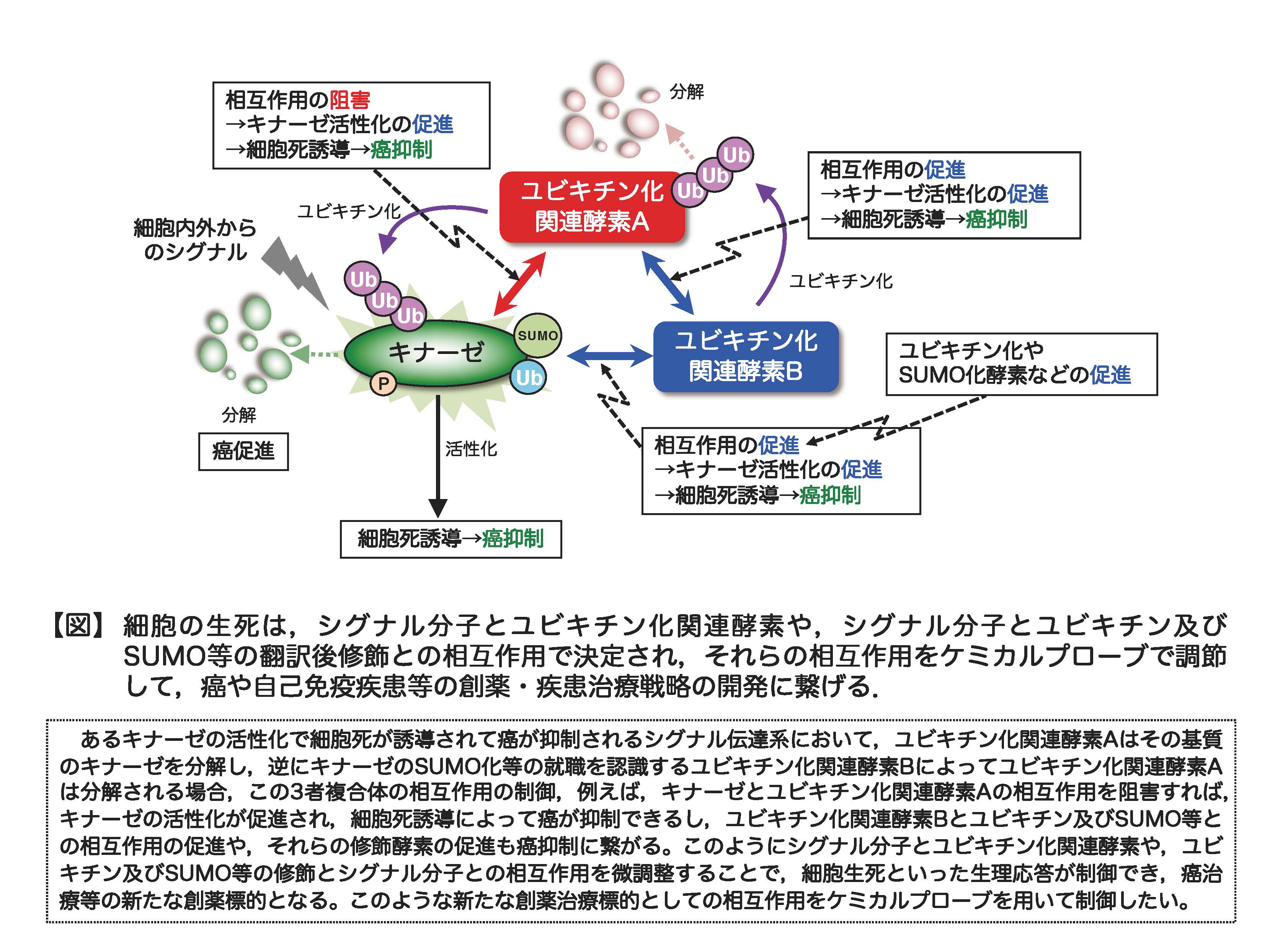
細胞の生死などの生理応答は、細胞内外から入力される様々な増殖・分化・細胞死などのシグナルのバランスによって決定されています。最近我々は、細胞生死に関わるシグナル分子に対して複数のユビキチン化関連酵素がクラスタリングして複合体を形成し、相互に活性制御を行うことで、細胞の生死を決定するシグナルバランスが微調整され、最終的に適切な細胞応答が誘導される普遍的な仕組みがあることを見出しました。そのシグナルバランスが崩れると異常なシグナルが誘導されて過剰な細胞死や増殖が起こり、癌や自己免疫疾患に繋がることが分かってきたわけです。また我々は、複合体内の複数のユビキチン化関連酵素同士の相互作用には、ユビキチン化やSUMO化などの修飾が必須であることも明らかにしており、従って、これらの修飾を制御できれば、過剰な細胞死や増殖を抑制し、細胞生死シグナルのバランス破綻による癌や自己免疫疾患等の疾患治療が可能となります。
例えば、細胞生死を調節する、あるキナーゼには、その活性制御を行う、異なるユビキチン化関連酵素が存在して複合体を形成し、一方のユビキチン化関連酵素は直接、キナーゼのユビキチン化分解に関わり、もう一方のユビキチン化関連酵素は一方のユビキチン化関連酵素のユビキチン化分解に寄与するという、シグナルの複雑な微調整の仕組みも存在します(【図】参照)。これらの分子間の相互作用には、ユビキチン化やSUMO化等が必要であることも分かってきました。すなわち、このような複合体形成メカニズムや細胞生死シグナルのバランス制御の仕組みを分子レベルで解明し、シグナル分子間相互作用やシグナル分子によるユビキチンやSUMOの認識が、細胞生死のシグナルバランスの決定に重要なポイント(作用点)であり、それらのポイントがケモテクノロジーによって分子レベルで人為的に調節制御可能であると考えています。
本研究では、ケモテクノロジーを活用して、ユビキチン化関連修飾とユビキチン化関連酵素を含むシグナル分子との相互作用などを正・負に適切に調節することで、細胞生死といった生理応答のシグナルバランス制御を介して過剰な細胞死・増殖などの現象を抑制し、癌や免疫疾患などに対する、従来の方法とは異なる新たな疾患治療戦略の提言を目指したいと考えています。
研究概要を示す模式図
本領域での研究成果
- Yokosawa T, Yamada M, Noguchi T, Suzuki S, Hirata Y, *Matsuzawa A.
Pro-caspase-3 protects cells from polymyxin B-induced cytotoxicity by preventing ROS accumulation.
J. Antibiotics 72, 848-852 (2019)
PMID: 31371783 - Sekiguchi Y, Yamada M, Noguchi T, Noomote C, Tsuchida M, Kudoh Y, Hirata Y, *Matsuzawa A.
The anti-cancer drug gefitinib accelerates Fas-mediated apoptosis by enhancing caspase-8 activation in cancer cells.
J. Toxicol. Sci. 44, 435-440 (2019)
PMID: 31168030 - Abe T, Shizu R, Sasaki T, Shimizu Y, Hosaka T, Kodama S, Matsuzawa A, Yoshinari K.
Functional Interaction between Pregnane X Receptor and Yes-Associated Protein in Xenobiotic-Dependent Liver Hypertrophy and Drug Metabolism.
J. Pharmacol. Exp. Ther. 371, 590-601 (2019)
PMID: 31533970 - Yamada M, Suzuki M, Noguchi T, Yokozawa T, Sekiguchi Y, Mutoh N, Toyama T, Hirata Y, Hwang GW, *Matsuzawa A.
The antibiotic cefotaxime works as both an activator of Nrf2 and an inducer of HSP70 in mammalian cells.
BPB Rep. 3, 16-21 (2020) - Hirata Y, Inoue A, Suzuki S, Takahashi M, Matsui R, Kono N, Noguchi T, *Matsuzawa A.
trans-Fatty acids facilitate DNA damage-induced apoptosis through the mitochondrial JNK-Sab-ROS positive feedback loop.
Sci. Rep. 10, 2743 (2020)
PMID: 32066809
プレスリリース
https://www.tohoku.ac.jp/japanese/2020/02/press20200227-02-trance.html
https://www.tohoku.ac.jp/en/press/how_trans_fats_assist_cell_death.html - Tsuchida M, Yokosawa T, Noguchi T, Shimada T, Yamada M, Sekiguchi Y, Hirata Y, *Matsuzawa A.
Pro-apoptotic functions of TRAF2 in p53-mediated apoptosis induced by cisplatin.
J. Toxicol. Sci. 45, 219-226 (2020)
PMID: 32238696 - Luong NC, Abiko Y, Shibata T, Uchida K, Warabi E, Suzuki M, Noguchi T, Matsuzawa A, *Kumagai Y.
Redox cycling of 9,10-phenanthrenequinone activates epidermal growth factor receptor signaling through S-oxidation of protein tyrosine phosphatase 1B.
J. Toxicol. Sci. 45, 349-363 (2020)
PMID: 32493877 - Hirata Y, Nada Y, Yamada Y, Toyama T, Fukunaga K, Hwang GW, Noguchi T, *Matsuzawa A.
Elaidic acid potentiates extracellular ATP-induced apoptosis via the P2X7-ROS-ASK1-p38 axis in microglial cell lines.
Biol. Pharm. Bull. 43, 1562-1569 (2020)
PMID: 32999166 - Kudo T, Tominami K, Izumi S, Hayashi Y, Noguchi T, Matsuzawa A, Hong G, Nakai J.
Characterization of PC12 cell subclones with different sensitivities to programmedthermal stimulation.
Int. J. Mol. Sci., 21, 8356 (2020)
PMID: 33171774 - Suzuki M, Asai Y, Kagi T, Noguchi T, Yamada M, Hirata Y, *Matsuzawa A.
TAK1 Mediates ROS Generation Triggered by the Specific Cephalosporins through Noncanonical Mechanisms.
Int. J. Mol. Sci., 21, 9497 (2020)
PMID: 33327477 - Udagawa T, Seki M, Okuyama T, Adachi S, Natsume T, Noguchi T, Matsuzawa A, Inada T.
Failure to Degrade CAT-Tailed Proteins Disrupts Neuronal Morphogenesis and Cell Survival.
Cell Rep. 34, 108599 (2021)
PMID: 33406423
プレスリリース - Noguchi T, Sekiguchi Y, Kudoh Y, Naganuma R, Kagi T, Nishidate A, Maeda K, Ishi C, Toyama T, Hirata Y, Hwang GW, *Matsuzawa A.
Gefitinib initiates sterile inflammation by promoting IL-1β and HMGB1 release via two distinct mechanisms.
Cell Death Dis. 12, 49 (2021)
PMID: 33414419
プレスリリース
代表的な論文
- Matsuzawa A, Tseng PH, Vallabhapurapu S, Luo JL, Zhang W, Wang H, Vignali DA, Gallagher E, *Karin M.
Essential cytoplasmic translocation of a cytokine receptor-assembled signaling complex.
Science (Research Article) 321, 663-668 (2008)
PMID: 18635759 - Maruyama T, Araki T, Kawarazaki Y, Naguro I, Heynen S, Aza-Blanc P, Ronai Z, Matsuzawa A, *Ichijo H.
Roquin-2 promotes ubiquitin-mediated degradation of ASK1 to regulate stress responses.
Sci. Signal. 7, ra8 (2014)
PMID: 24448648 - *Matsuzawa A.
Thioredoxin and redox signaling: Roles of the thioredoxin system in control of cell fate.
Arch. Biochem. Biophys. 617, 101-105 (2017)
PMID: 27665998 - Hirata Y, Katagiri K, Nagaoka K, Morishita T, Kudoh Y, Hatta T, Naguro I, Kano K, Udagawa T, Natsume T, Aoki J, Inada T, Noguchi T, Ichijo H, *Matsuzawa A.
TRIM48 promotes ASK1 activation and cell death through ubiquitination-dependent degradation of the ASK1 negative regulator PRMT1.
Cell Rep. 21, 2447-2457 (2017)
PMID: 29186683 - Noguchi T, Suzuki M, Mutoh N, Hirata Y, Tsuchida M, Miyagawa S, Hwang G W, Aoki J, *Matsuzawa A.
Nuclear-accumulated SQSTM1/p62-based ALIS act as microdomains sensing cellular stresses and triggering oxidative stress-induced parthanatos.
Cell Death Dis. 9, 1193 (2018)
PMID: 30546061





