高橋 宏隆
USPファミリーの脱ユビキチン化酵素を特異的に阻害する低分子化合物の開発
 |
研究代表者 高橋 宏隆愛媛大学 プロテオサイエンスセンター 無細胞生命科学部門 講師 |
|---|
研究概要
脱ユビキチン化酵素(DUB)は、ユビキチン化されたタンパク質からユビキチンを除去したり、ポリユビキチン鎖を切断するプロテアーゼです。DUBは標的タンパク質のプロテアソーム分解からの保護や、ユビキチン化修飾によるシグナル伝達の抑制などを介して、様々な細胞応答を制御する重要な因子です。近年、細胞内においてDUBが高発現することで、本来分解されるべきタンパク質の異常蓄積などを引き起こし、これが様々な疾患の原因となることが報告されており、DUBは創薬の新たなターゲットとして注目されています。
本研究では、愛媛大学プロテオサイエンスセンターが独自に開発したコムギ無細胞タンパク質合成系を駆使し、ハイスループットなDUBの阻害剤探索系と、40種類以上のDUB組換えタンパク質を用いたDUB阻害剤特異性の評価系の構築を行ってきました(図1)。これまでに我々はUSPファミリーのDUB(以下、USP)に高度に保存された酵素活性部位に結合し、USPのみを阻害するユニークな低分子化合物Subquinocinを見出しています。USPファミリーは約100種類と言われるDUBの半数以上を占めており、生理学的に重要なDUBが多く含まれております。
本研究ではこのSubquinocinをベース化合物として、in silico解析手法を基盤に、特定のUSPのみを特異的に阻害する誘導体化合物の取得を目指します。特に本研究では、タンパク質分解や炎症・免疫応答シグナルに重要な役割を担うUSP14, USP15, CYLDの3種のUSPに着目し、これらの特異的阻害剤の開発を目標とします(図2)。得られたUSP特異的阻害剤は、細胞内におけるUSPの機能や役割の解明において非常に有用なケミカルプローブとなるだけでなく、USPが関与する疾患への創薬のシーズとしても期待されます。また本研究を通じて、DUB特異的阻害剤を創出できるプラットフォームを構築し、国内外のDUB阻害剤開発への貢献を目指します。
研究概要を示す模式図
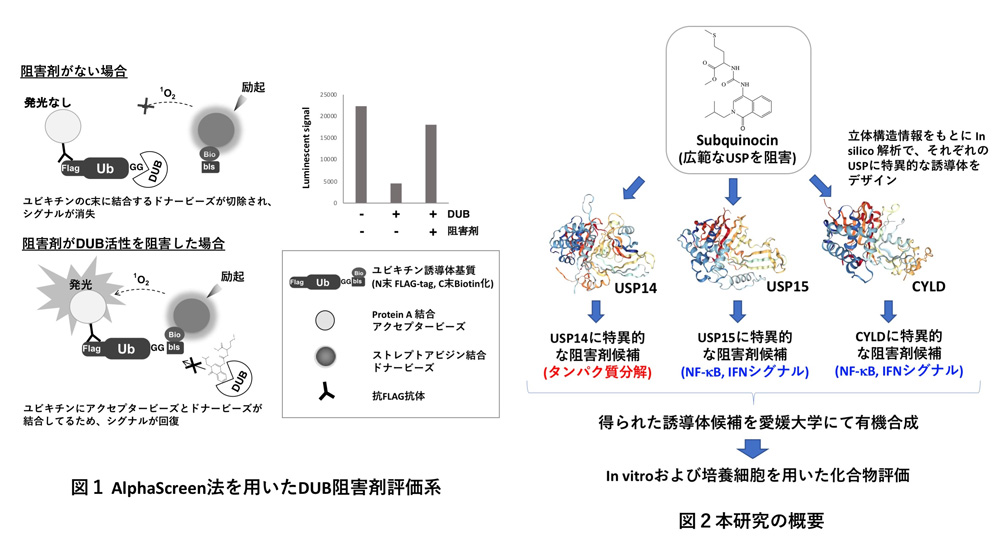
Figure 1. (a) JAZの相互作用相手に応じた構造変化. (b) COI1特異的Loop-stapled peptide (LSP)の設計戦略.
本領域での研究成果
- Uematsu A, Kido K, Takahashi H, Takahashi C, Yanagihara Y, Saeki N, Yoshida S, Maekawa M, Honda M, Kai T, Shimizu K, Higashiyama S, Imai Y, Tokunaga F, *Sawasaki T.
The E3 ubiquitin ligase MIB2 enhances inflammation by degrading the deubiquitinating enzyme CYLD.
J. Biol. Chem. 294, 14135–14148 (2019)
PMID: 31366726 - Nomura S, Takahashi H, Suzuki J, Kuwahara M, Yamashita M, *Sawasaki T.
Pyrrothiogatain acts as an inhibitor of GATA family proteins and inhibits Th2 cell differentiation in vitro.
Sci. Rep. 9,17335 (2019)
PMID: 31758034 - Yamanaka S, Sato Y, Oikawa D, Goto E, Fukai S, Tokunaga F, *Takahashi H, *Sawasaki T.
Subquinocin, a small molecule inhibitor of CYLD and USP-family deubiquitinating enzymes, promotes NF-κB signaling.
Biochem. Biophys. Res. Commun. 524, 1-7 (2020)
PMID: 31898971 -
*Takahashi H, Yamanaka S, Kuwada S, Higaki K, Kido K, Sato Y, Fukai S, Tokunaga F, *Sawasaki T.
A Human DUB Protein Array for Clarification of Linkage Specificity of Polyubiquitin Chain and Application to Evaluation of Its Inhibitors.
Biomedicines 8, 152 (2020)
PMID: 32512835 - Inoue S, Kaiserli E, Zhao X, Waksman T, Takemiya A, Okumura M, Takahashi H, Seki S, Shinozaki K, Endo Y, Sawasaki T, Kinoshita T, Zhang X, Christie J, Shimazaki K.
CIPK23 regulates blue light-dependent stomatal opening in Arabidopsis thaliana.
Plant J. 104, 679-692 (2020)
PMID: 32780529 - Nakabayashi O, Takahashi H, Moriwaki K, Komazawa-Sakon S, Ohtake F, Murai S, Tsuchiya Y, Koyahara Y, Saeki Y, Yoshida Y, Yamazaki S, Tokunaga F, Sawasaki T, Nakano H.
MIND Bomb 2 prevents TNF-induced apoptosis via two distinct mechanisms.
Commun. Biol. 4, 80 (2021)
PMID: 33469115 - Yamanaka S, Murai H, Saito D, Abe G, Tokunaga E, Iwasaki T, Takahashi H, Takeda H, Suzuki T, Shibata N, Tamura K, Sawasaki T.
Thalidomide and its metabolite 5-hydroxythalidomide induce teratogenicity via the cereblon neo-substrate PLZF.
EMBO journal. 40, e105375 (2021)
PMID: 33470442
代表的な論文
- Takahashi H, Nozawa A, Seki M, Shinozaki K, Endo Y, *Sawasaki T.
A simple and high-sensitivity method for analysis of ubiquitination and polyubiquitination based on wheat cell-free protein synthesis.
BMC Plant Biol. 9, 39 (2009)
PMID: 19348673 - Takahashi H, Ozawa A, Nemoto K, Nozawa A, Seki M, Shinozaki K, Takeda H, Endo Y, *Sawasaki T.
Genome-wide biochemical analysis of Arabidopsis protein phosphatase using a wheat cell-free system.
FEBS Lett. 586, 3134-3141 (2012)
PMID: 22968126 - Takahashi H, Takahashi C, Moreland NJ, Chang Y-T, Sawasaki T, Ryo A, Vasudevan SG, *Suzuki Y, *Yamamoto N.
Establishment of a robust dengue virus NS3-NS5 binding assay for identification of protein-protein interaction inhibitors.
Antiviral Res. 96, 305-314 (2012)
PMID: 23072882 - Takahashi H, Nemoto K, Ramadan A, *Sawasaki T.
Technology of wheat cell-free based protein array for biochemical analyses of protein kinases and ubiquitin E3 ligases. In: Inoue J, Takekawa M (eds)
Protein Modifications in Pathogenic Dysregulation of Signaling. Springer Japan, 43-60 (2015) - Takahashi H, Uematsu A, Yamanaka S, Imamura M, Nakajima T, Doi K, Yasuoka S, Takahashi C, Takeda H, *Sawasaki T.
Establishment of a Wheat Cell-Free Synthesized Protein Array Containing 250 Human and Mouse E3 Ubiquitin Ligases to Identify Novel Interaction between E3 Ligases and Substrate Proteins.
PLoS ONE 11, e0156718 (2016)
PMID: 27249653 - Yonezawa T, Takahashi H, Shikata S, Sawasaki T, Kitamura T, Goyama S.
The ubiquitin ligase RNF38 promotes RUNX1 ubiquitination and enhances RUNX1-mediated suppression of erythroid transcription program.
Biochem. Biophys. Res. Commun.505, 905-909 (2018)
PMID: 30309654





